In diesem Beitrag stelle ich die bekanntesten Atommodelle vor: Brownsche Molekularbewegung, Kugelmodell, Modell von Thomson, Kern-Hülle-Modell, Bohrsche Atommodell und neuere Theorien.
Atommodelle
Bereits die Griechen haben sich darüber Gedanken gemacht, woraus die Materie besteht. Ist alles beliebt oft teilbar oder würden wir im Gegensatz auf unteilbare Elemente stoßen? Unteilbar heißt auf griechisch Atom, deshalb hat man diesen Ausdruck beibehalten. Auch dieses Modell hat sich bewährt, denn damit können wir viele physikalische Beobachtungen erklären.
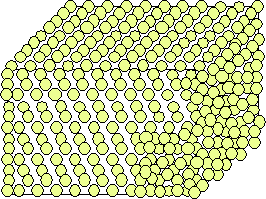
Wir können uns den Aufbau fester Körper also aus regelmäßig angeordneten Gitterbausteinen vorstellen.
Wärmeenergie kann man dadurch als Schwingungen der Gitterbausteine um eine Ruhelage erklären.
Dies erklärt außerdem die Ausdehnung eines solchen Körpers bei Erwärmung.
Denn wenn sich die Schwingungsenergie und Amplitude sich erhöhren, braucht der Körper mehr Platz.
Brownsche Molekularbewegung
Das Atome tatsächlich existieren, konnte man durch viele Beobachtungen bestätigen. Allerdings sind diese Teilchen so klein, dass sie selbst mit den besten Mikroskopen nicht zu sehen sind. Wie können uns deshalb nur vorstellen, wie Atome aussehen können. Physiker haben verschiedene Atommodelle entwickeln, mit denen sie bestimmte Erscheinungen erklären können.
Keines der Atommodelle gibt jedoch genau an, wie die Atome wirklich aussehen. Jedes Modell ist nur eine Vorstellungshilfe.
Das Kugelmodell
John Dalton stellte im 18. Jahrhundert die Theorie auf, Atome seien elastische, vollständig mit Masse gefüllte Kugeln. Sie sind unteilbar, besitzen Haftstellen und können sich zu Molekülen oder zu Festkörpern verbinden. Die Atome der verschiedenen Elemente sind unterschiedlich.
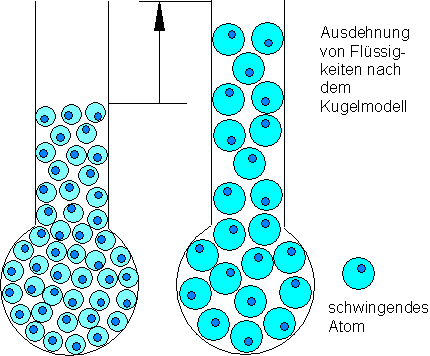
Mit diesem Kugelmodell lassen sich viele Erscheinungen aus der Wärmelehre erklären. Die Atome einer Flüssigkeit schwingen um ihre Ruhelage. Durch die Schwingungsbewegung benötigen sie mehr Platz, als wenn sie in Ruhe wären. Bei Erwärmung erhöht sich die Schwingungsenergie. Die Atome benötigen noch mehr Platz. Die Flüssigkeit dehnt sich aus.
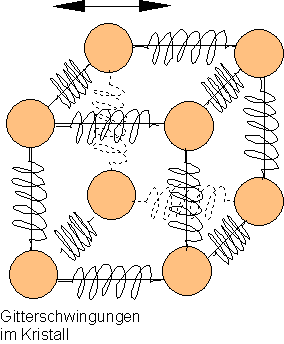
Die Atome eines Festkörpers kann man sich vorstellen, als seien sie durch Spiralfedern miteinander verbunden.
Sie können ebenfalls um ihre Ruhelage schwingen. Auch bei den Festkörpern erhöht sich bei Erwärmung die Schwingungsenergie. Die Atome brauchen mehr Platz, der Festkörper dehnt sich aus.
Wird z.B. Eisen geschmolzen, so kann man sich das so vorstellen, als würden die Federn zwischen den Atomen zerreißen. Eisen verhält sich dann wie eine Flüssigkeit.
Allerdinga hatte das Kugelmodell auch Grenzen. Elektrische Leitungsvorgänge kann man damit zum Beispiel nicht erklären. Es fehlt die elektrische Ladung.
Das Modell von Thomson (modifiziertes Kugelmodell 19. Jahrhundert)
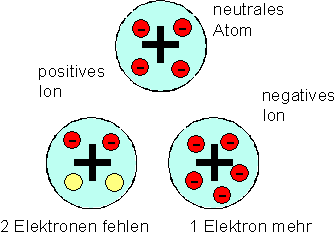
Joseph John Thomson stellte sich die Atome als kleine Kugeln aus positiv geladenem Stoff vor. In ihnen sind so viele negativ geladene Elektronen eingebettet, dass die positive Ladung gerade neutralisiert wird. Die Atome können zusätzlich Elektronen aufnehmen oder Elektronen abgeben. Es entstehen negative und positive Ionen. In Metallen sind demzufolge nicht alle Elektronen an die Atome gebunden, sondern zum Teil beweglich.
Versuch von Rutherford
Ernest Rutherford wollte das Thomsonsche Atommodell überprüfen (1911). Er beschoss dazu eine sehr dünne Goldfolie mit einem Strahl positiver Teilchen. Dann untersuchte er, unter welchem Winkel diese Teilchen gegen die Einfallsrichtung gestreut werden. Hierzu tastete er den Raum um die Goldfolie mit einem Leuchtschirm ab und zählte die Lichtblitze, die durch den Einschlag der gestreuten Teilchen entstanden.
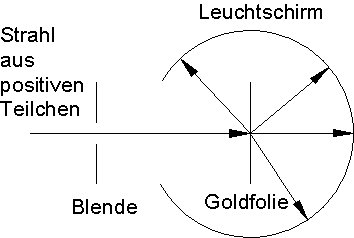
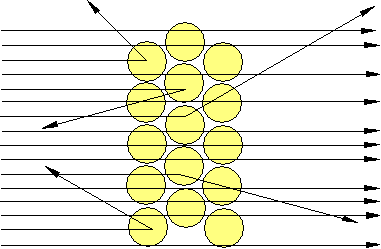
Er erwartete, dass die Teilchen durch die Atome hindurchfliegen und kaum aus ihrer Richtung abgelenkt würden (wie durch einen Pudding). Die gleichmäßig über die Kugel verteilte positive Ladung würde die positiven Geschosse nur geringfügig ablenken. Doch das Resultat war gänzlich anders. Viele Teilchen gingen geradlinig hindurch, doch wurden bei allen Winkeln auch gestreute Teilchen beobachtet.
Das Kern-Hülle-Modell
Jedes Atom besteht aus dem Atomkern und der Atomhülle. Der Atomkern ist dabei positiv geladen und enthält fast die gesamte Masse des Atoms. In der Atomhülle bewegen sich die negativ geladenen Elektronen. Ihre Masse ist etwa 2000 mal so klein wie die eines Wasserstoffatoms. Der Atomkern hat einen Durchmesser von weniger als 3 mal 10-14 m, das ganze Atom aber etwa 10-9 m. Das bedeutet dass das Innere eines Atoms praktisch leer ist.
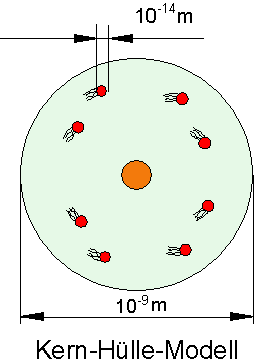
Größenverhältnis im Atom:
Um die zu veranschaulichen, hierzu ein Beispiel:
Wenn der Atomkern die Größe einer Erbse hätte, dann wäre sie 400 Meter von der Hülle entfernt.
Das entspricht etwa der Länge von vier Fußballfeldern.
Könnte man die Materie eines Supertankers (400.000 t) so zusammenpressen, dass kein Zwischenraum mehr vorhanden ist, so hätte der Tanker die Größe einer Streichholzschachtel.
Die Erde hat einen Durchmesser von etwa 12.000 km. Zusammengepresst wäre sie eine Kugel von 120 m Durchmesser.
Das Bohrsche Atommodell (Schalenmodell)
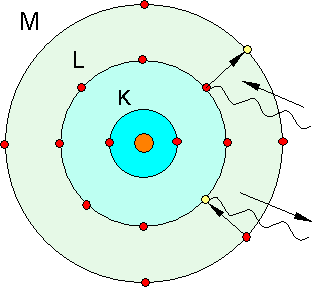
Niels Bohr ergänzte das Rutherfordsche Atommodell, indem er genaue Aussagen über die Atomhülle machte.
1. Ein Elektron kann den Kern nur auf bestimmten Bahnen strahlungslos umlaufen. Dabei besitzt es eine bestimmte Energie Wn.
2. Der Übergang von einer kernferneren stationären Bahn zu einer kernnäheren erfolgt sprunghaft und unter Abgabe eines Energiequants.
Die maximale Anzahl der Elektronen einer Schale beträgt z = 2 mal n2 (n = 1,2,.. 7) (maximale Besetzung erfolgt nur bis Schale 4 ( N-Schale).
Mit dem Schalenmodell lässt sich auch die Lichtstrahlung erklären.
Thermische Anregung:
Durch Erwärmen wird die Molekularbewegung vergrößert. Stöße zwischen den Atomen heben die Elektronen auf höhere Bahnen.
Fotoanregung:
Die Energie auffallender Photonen hebt die Elektronen auf das höhere Niveau (Fluoreszenz, Phosphoreszenz).
Elektrische Anregung:
In Gasentladungslampen treffen Ionen und Elektronen mit hoher Geschwindigkeit auf die Atome und werden dadurch angeregt. An der Erzeugung sichtbaren Lichtes sind nur die äußeren Elektronen thermisch optisch oder elektrisch angeregter Atome beteiligt.
Neuere Theorien
Inzwischen gibt es Theorien, dass auch die Protonen und Elektronen aus noch kleineren Teilen bestehen, die sich z. B. Quarks nennen. Aber das bisherige Atommodell genügt für den Physikunterricht.
Hier findest du eine Übersicht über weitere Beiträge zum Thema Elektronik, darin auch Links zu Aufgaben.